La energía de activación es la energía minima necesaria para que los reactivos choquen con la orientación adecuada. Si ésta energía es pequeña, la reacción será rápida o incluso espontanea.
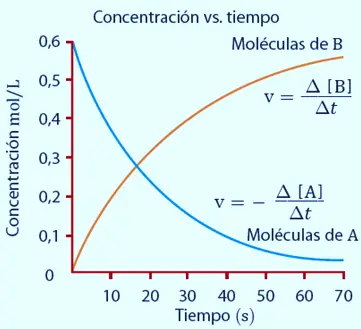
La velocidad de una reacción es la cantidad de sustancia que se obtiene o desaparece por unidad de tiempo.
Podría expresarse así: v = n/t (moles que aparecen o desaparecen por unidad de tiempo)
En la reacción A ---> B será:
FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN
Video
La velocidad de reacción aumenta con los siguientes factores:
- Si aumenta la concentracion de los reactivos, ya que aumenta el número de choques efectivos entre sus partículas, están más juntas.
- Si aumenta la superficie de contacto, ya que abrá más superficie y mas choques. (Recordad que esto significa que los reactivos estén finamente divididos y no en trozos más grandes. Si sumamos la superficie de pequeñas partículas, será mayor, que la de un bloque grande.)
- Si aumenta la temperatura, ya que las particulas se moverán a mayor velocidad.
- Si se usan catalizadores. Los catalizadores son sustancias que modifican la velocidad de reacción pero no intervienen en ella. No son reactivos ni productos. Su presencia hace que la velocidad aumente, pero al terminar la reacción no se ha consumido nada, habrá la misma cantidad que al inicio. Normalmente disminuyen la energía de activación.
No, ya que esta reacción se iguala en los dos casos, unos de los sumandos siempre pasa multiplicando al otro lado.
ResponderEliminar11)Sí se conserva la masa.
ResponderEliminarSe mete en un recipiente para que la suma de las masas de los reactivos sea igual a la suma de las masas de los productos.El recipiente tiene que estar cerrado para que los gases producidos no se escapen
Al÷108g + O2÷x=Al²O³÷204g
ResponderEliminar108:x-204
x=20-108=96g
Este es el ejercicio 15
12.000-200=11.800 g de gases en forma de humo
ResponderEliminar9)
ResponderEliminara)4Fe + 3O2 = 2Fe2O3
b)Esta ajustada
c)FeS + 2HCl = FeCl2 + H2S
d)Esta ajustada
e) 2H2O2 = 2H2O + O2
f)2Ca + O2 = 2CaO
g)Esta ajustada
Actividad 13
ResponderEliminarLos reactivos en esta reacción química son el estaño y el oxígeno del aire.
Sí se cumple la ley de conservación de la masa ya que la masa de la chapa oxidada es igual a la masa de la chapa de estaño original más la masa de oxígeno que se ha consumido en la reacción.
Ejercicio 14 de Química
ResponderEliminarCaCO2/160 kg= Ca + CO2/89'6
Ley de Lavoisier: Masa reactiva = Masa del producto
160 = 89'6 + x
x = 160-89'6 = 70'4