Un elemento es un conjunto de átomos de la misma clase. Ej: Diamante, grafito, O2, H2, ...
Un compuesto es una sustancia formada por átomos diferentes. Ej: Agua, butano, NaCl, ...
Tabla periódica de los elementos: organización de los elementos químicos colocados en orden creciente de número atómico. La escalera (semimetales) separa a los metales (a la izquierda) de los que tienen un comportamiento no metálico (a la derecha).
El hidrógeno no tienen un comportamiento metálico, es una excepción. Algunos elementos tienen un origen artificial, es decir, no se encuentran en la naturaleza. Cada uno se encuentra en un estado, es decir, en condiciones ambientales, pueden ser sólidos, líquidos o gaseosos.
Grupo o familia: Es cada una de las 18 filas verticales. Ej: Alcalinos, halógenos, gases nobles,...
Períodos: Son cada una de las 7 filas horizontales. Ej: Nivel 1, nivel 2,...
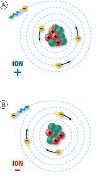
Ion: Átomo con carga eléctrica, es decir, ha ganado electrones (Anión) como el Cl-, o ha perdido electrones (Catión) como el Na+.
Regla del octeto: Los átomos tienden a adquirir la estructura electrónica de un gas noble (s2p6, 8 e-), es decir, a completar (Cl-), o vaciar (Na+) su última capa.
Todos los elementos de un mismo grupo tienen el mismo número de electrones en la última capa denominada capa de valencia, por lo que sus propiedades químicas son similares. La configuración electrónica de un elemento permite deducir el grupo al que pertenece y su comportamiento químico general.
Las moléculas o cristales son agrupaciones estables ya que los átomos ganan, pierden o comparten electrones.
- Las moléculas están formadas por un un número pequeño y fijo (concreto) de átomos. Ej: Nitrógeno (elemento), Propano (compuesto).
Son malas conductoras de la electricidad (no tienen electrones libres) y del calor. Las fuerzas entre ellas son débiles, por lo que suelen ser gases o líquidos a temperatura ambiente.
Estructuras de Lewis: Son representaciones de la unión de los átomos en las moléculas; así como de la posición de los electrones enlazantes y no enlazantes. Las parejas de electrones se muestran mediante guiones y pueden ser de enlace (son electrones compartidos que cuentan para dos átomos) o de no enlace (par solitario, no participa en el enlace, solo se cuentan en un átomo). Cada átomo tiene que cumplir la regla del octeto. Se parte de la configuración electrónica del átomo para saber cuantos electrones tiene en su última capa (electrones de valencia).
Ej: H2O H: 1s2 O: s2p4
- Los cristales están formados por un número grande y variable de átomos ordenados (si no lo están serán amorfos). Pueden ser de tres tipos:
Página 55 del libro:
Formulación
Masa molecular y composición centesimal:
Masa molecular es la suma de las masas atómicas de todos los átomos que forman una molécula, se expresa en unidades de masa atómica o dalton.
Composición centesimal es el porcentaje de masa de un átomo en un compuesto.